
こんにちは、四谷学院の岩佐です。
11月11日はどんな風に過ごされましたか?
私はポッキーではなく、プリッツを食べました。
CMにつられて、つい。
そこで(?)、ざっと調べてみたところ・・・
11月11日は、「1年で一番記念日が多い日」だそうです。
ちなみに10月10日も同率トップ。
さて、11月11日は電池の日でもあります。
その理由を調べてみたら、こうでした。
「11は漢字で書くと十一で、プラスとマイナスが並ぶから」
…
…
…
はっ。(←意識を取り戻したところ)
「高校化学」における電池
高校化学における「電池分野」のポイントをざっと押さえると、重要な電池について
- 電池式を書くことができる
- 両極での反応を書くことができ、その反応に基づいて量的計算ができる
- 電池のもつ特徴を説明できる
といったところになるでしょう。
そして、入試における重要な電池とは
- ダニエル電池
- 鉛蓄電池
- 燃料電池
この3つです。
教科書で大きくスペースをとって説明されているのも、この3つでしょう。
「ダニエル電池」については、金属のイオン化傾向の違いを利用していることを理解し、イオン化傾向の違いが大きいほど起電力が大きくなることを押さえましょう。
鉛蓄電池
「ダニエル電池」「鉛蓄電池」「燃料電池」
この3つの中では、「鉛蓄電池」が計算も含めて最もよく出題されるでしょう。
放電時の両極の反応
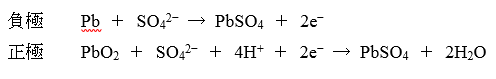
これをともかくしっかり覚えてください。

燃料電池は、ダニエル電池や鉛蓄電池に比べてとらえにくく感じられるかもしれませんが、
「両極での反応を合わせると、結果的に燃焼反応が起こっている」
ので燃料電池という名前がついているんだ、と思ってもらえれば、何となくなじみやすくなるのではないでしょうか。
単に「燃料電池」という場合、通常「燃料」に当たるのは水素です。電解液がリン酸水溶液のような酸型の燃料電池の場合、両極での反応は次のようになります。

が得られます。
覚える式が多くてめんどくさい?
そんなことはないですよ。

この、酸型の燃料電池の式は、「水の電気分解を逆向きに進めている」のと、ほぼ同じことです。純粋な水は電気を通しにくいので、代わりに希硫酸を電気分解すると、陰極と陽極で起こるのはこんな反応ですよね?
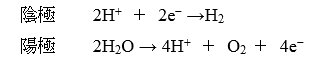
これがすらすら書けるようになっていれば、酸型の燃料電池はこれを引っくり返すだけでいいんです。
同じように、塩基型の燃料電池(電解液が水酸化カリウム水溶液など)の場合は、水酸化カリウム水溶液の電気分解を考えて、それを引っくり返せばよいのです。
ぜひ自分で確かめてみてください。
四谷学院ではダブル教育で、苦手な科目は基礎からじっくり。得意な科目はどんどん進められます。
詳しくは入学説明会でもお話しています。まずはお気軽にホームページをご覧ください。



